中药三叶青提取物抗肿瘤机制初探
来源:《中国卫牛检验杂志》 2006年1月 第l6卷 第1期
作者:徐彩菊,丁钢强,孟佳,傅剑云,章荣华,陈玉满,陈 江(浙江省疾病预防控制中心)
摘 要:
目的 通过对三叶青提取物小鼠免疫调节功能的评价,初步确定其抗肿瘤作用的基本机制;
方法 从细胞免疫、体液免疫、单核一巨噬细胞吞噬作用和自然杀伤细胞的攻击作用4个方面观察三叶青提取物对小鼠免疫功能的影响;
结果 三叶青提取物5.0、15.0、25.0 S/kg·BW 剂量组均能提高ConA诱导的小鼠脾淋巴细胞的增殖能力和小鼠左后足跖部厚度差24 h测量值,2.5、5.0 g/kg·BW 剂量组均能提高小鼠溶m空斑数,2.5、5.0、15.0和25.0 S/kg·BW 剂量组均能提高小鼠碳廓清的能力,15.0 g/kg·BW剂最组能提高小鼠腹腔巨噬细胞吞噬鸡红细胞的吞噬指数;
结论 三叶青提取物具有增强小鼠免疫力作用,为其抗肿瘤作用机制之一。
关键词:三叶青提取物;小鼠免疫功能;抗肿瘤机制
三叶青为葡萄科崖爬藤属植物,学名为三叶崖爬藤(Tet—rastigma Hemsleyanum DieIset.Gilg)。生于林中阴处,沟谷土壤肥沃湿润处,主要分布于浙江、江西、福建、台湾、湖北、湖南、广东、广西、四川、贵州、云南等省区[1]。三叶青以块根或全草入药,具有清热解毒、祛风化痰、活血止痛的功效,用于治疗高热惊厥、肺炎、哮喘、肝炎、风湿、月经不调、咽痛、瘰疬等症,具有很好的疗效[2]。药理实验表明三叶青提取物有抗病毒作用和明显的消炎镇痛[3]及保肝作用[4],在民间三叶青还用于肿瘤的治疗。三叶青为中国特有物种,又主产于浙江。为了开发和利用本土资源,我们对其抗肿瘤机理的一个方面一机体免疫调节作用进行了研究。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级ICR雌性小鼠,体重18—22 g,由中科院海实验动物中心提供,实验动物生产许可证号为SCXK(沪)2002—0010。
1.1.2 受试物 三叶青提取物采用乙酸乙酯提取法。
1.2 方法
参照《免疫毒理学实验技术》 0。试验项目包括:
1.2.1 剂量设计实验设4个剂量组和一个蒸馏水对照组。剂量分别为2.5、5.0、15.0、25.0 g/kg·BW。
1.2.2 小鼠脏器/体重比值测定(包括胸腺/体重和脾脏/体重比值) 雌性ICR小鼠50只,体重18—22 g,随机分5组。每日分别以2.5、5.0、15.0、25.0 g/kg·BW 剂量给予受试物,连续灌胃给受试物30 d。另设阴性对照组。
1.2.3 细胞免疫功能测定
1.2.3.1 ConA诱导的小鼠脾淋巴细胞转化试验(MrIT)法。动物及剂量同1.2.2。
1.2.3.2 绵羊红细胞(SRBC)诱导小鼠DTH(足跖增厚法)。动物及剂量同1.2.2。
1.2.4 体液免疫功能测定
1.2.4.1 小鼠血清溶m素测定(血凝法)。动物及剂量同1.2.2。
1.2.4.2 抗体生成细胞检测(Jeme改良玻片法)。动物及剂量同1.2.2。
1.2.5 单核巨噬细胞吞噬功能测定
1.2.5.1 小鼠腹腔巨噬细胞吞噬鸡红细胞试验(半体内法)动物及剂量同1.2.2。
1.2.5.2 小鼠碳廓清试验。动物及剂量同l.2.2。
1.2.6 NK细胞活性测定(LDH测定法)动物及剂量同1.2.2。
1.2.7 统计方法 全部数据采用SPSS/PC软件包在微机上进行统一处理。
2 结果
2.1 对小鼠免疫器官的影响
从表l可见,三叶青提取物各剂量组小鼠胸腺/体重比值、脾脏/体重比值和阴性对照组(蒸馏水)比较,均无显著性差异(方差分析,P>0.05)。
2.2 对小鼠细胞免疫功能的影响
从表2可见,与阴性对照组(蒸馏水)比较,三叶青提取物5.0、15.0和25.0 g/kg·BW 剂量组均能提高ConA诱导的小鼠脾淋巴细胞的增殖能力和小鼠左后足跖部厚度差24h测量值,均有显著性差异(q检验,P<0.05)。
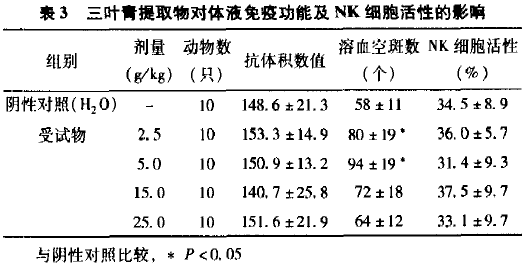
2.3 对小鼠体液免疫功能的影响
从表3可见,三叶青提取物各剂量组小鼠血清溶血素抗体积数值和阴性对照组(蒸馏水)比较,无显著性差异(方差分析,P>0.05)。与阴性对照组(蒸馏水)比较,2.5和5.0 kg·BW剂量组均能提高小鼠溶血空斑数,均有显著性差异(q检验,P<0.05)。
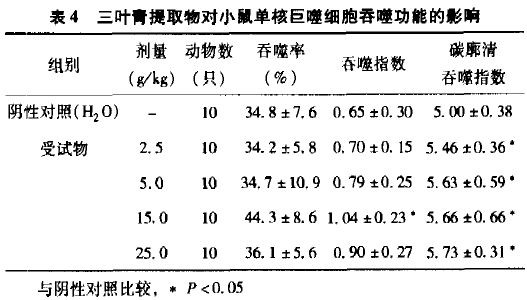
2.4 对小鼠单核巨噬细胞吞噬功能的影响
从表4可见,与阴性对照组(蒸馏水)比较,三叶青提取物15.0 r,/kg·BW 剂量组能提高小鼠腹腔巨噬细胞吞噬鸡红细胞的吞噬指数,有显著性差异(q检验,P<0.05);各剂量组均能提高小鼠吞噬碳末的吞噬指数,有显著性差异(q检验,P<0.i)5);小鼠腹腔巨噬细胞吞噬鸡红细胞的吞噬指数和阴性对照组(蒸馏水)比较,无显著性差异(方差分析,p>0.05)。
2.5 对小鼠NK细胞活性的影响
从表3可见,三叶青提取物各剂量组小鼠NK细胞活性和阴性对照组(蒸馏水)比较,无显著性差异(方差分析,P>0.05)。
3 讨论
三叶青的化学成分目前尚未十分明了,丁钢强等对三叶青的乙酸乙酯、正丁醇和水3种提取法进行了比较,结果显示以乙酸乙酯提取法效果最好[6]。通过三叶青的块根乙酸乙酯提取后李瑛琦等分离到7个化合物,经鉴定的有4个化合物,分别为8一谷甾醇、山奈酚、槲皮素和山奈酚一3一O一新橙皮糖苷[7]。槲皮素(Quercetin)足植物界分布最广,具有多种生物活性的黄酮类化合物,广泛存在于蔬菜和水果中,同时它也是多种中草药的成分。槲皮素具有抗肿瘤、降血压、降血脂、抗炎、抗过敏、抗病毒等多种生物学活性,所以对人类肿瘤、衰老、感染、心血管疾病的治疗和预防具有重要意义[8]。最近的研究表明,槲皮素一方面可以诱导多种肿瘤细胞凋亡[9-11],另一方面又可以阻止一些非肿瘤细胞凋亡的发生[12、13]。B一谷甾醇(B—sitostero1)和山奈酚(Kaempfero1)均属黄酮类化合物,对它们的生物活性作用研究得不多。三叶青含有多种生物活性成分,但其抗肿瘤机理尚不明确
机体的免疫应答过程是由一系列复杂的免疫反应组成的。完整的免疫系统包含了细胞免疫、体液免疫、单核一巨噬细胞吞噬作用和自然杀伤细胞的攻击作用。为了全面观察三叶青提取物在改善小鼠免疫力方面的功能,从而仞步确定其抗肿瘤作用的机制。我们选择了反应细胞免疫功能的小鼠脾淋巴细胞转化试验和迟发犁变态反应试验;反应体液免疫功能的抗体生成细胞检测和血清溶血素测定;反应单核一巨噬细胞吞噬功能的小鼠碳廓清试验和小鼠腹腔巨噬细胞吞噬鸡红细胞试验;反应自然杀伤作用的NK细胞活性测定。
从本试验结果可见,不同剂量的二叶青提取物对小鼠主要免疫器官(胸腺和脾脏)和NK细胞活性均无明显增强或抑制作用。三叶青提取物剂量为5.0、15.0、25.0 g/kg-BW 时其ConA诱导的小鼠脾淋巴细胞的OD差值和小鼠左后足跖部厚度差24 h测量值与对照组比较均有显著性差异,说明三叶青提取物能提高小鼠细胞免疫功能;2.5、5.0 g/kg-BW 两剂量组均能提高小鼠溶血空斑数,与对照组比较有显著性差异;2.5、5.0、15.0、5.0 g/kg·BW 四剂量组小鼠吞噬碳末的吞噬指数。15.0 g/kg·BW 剂量组能提高小鼠腹腔巨噬细胞吞噬鸡红细胞的吞噬指数,与对照组比较均有显著性差异,说明三叶青提取物能增强单核一巨噬细胞吞噬功能。
巨噬细胞除对异物、死亡细胞进行吞噬和消化外,还参与识别、吞噬和处理抗原、传递免疫信息等免疫反应过程。在细胞免疫反应中,巨噬细胞在胸腺依赖性抗原(TD抗原)致敏T淋巴细胞的过程中起着重要的作用;在体液免疫反应中,TD抗原活化B细胞也必须有巨噬细胞参与。因此,三叶青提取物增强小鼠免疫功能,可能与其首先激活巨噬细胞功能有关。
80年代初,肿瘤生物治疗的创始人之一Oldham博士提出牛物应答调节剂(biological response modifier,BMR)的概念,该理论普遍为美国医学界所接受[14]。我国传统中医理论强调整体,辨证论治,扶正固本,标本兼治,这些与BMR理论颇为吻合。调节机体免疫功能状态,使机体的抗肿瘤免疫功能得以加强是中药抗肿瘤重要机制之一。因此,调节机体的免疫功能也是三叶青提取物抗肿瘤作用的机制之一。至于三叶青提取物其他的抗肿瘤作用机理则有待于进一步的研究。
[参考文献]
[1] 中国医学科学院药物研究所.中药志[M].第2册.北京:人民卫生出版社,1984.219.
[2] 江苏新医学院.中药犬辞典[M]. 上海:上海人民出版社,l977.2l23.
[3] Zi GM,Ji 1 ,Hi,JC,et a1.Studies of anti—inflamnmtory action and a.nalysis ofhemsley reekvine(Tetra~tigma hemsleyanum)[J].Chin Tra+dit Herb Drugs,1980,11(4):145—146.
[4] Cai xL A study of tetrastigma hemsleyanum on liver functions of rabbit by the application of se Bengal[J].Chin Tradit Herb Drugs,1980。11(1):38—39,
[5]薛彬.免疫毒理学实验技术[M].北京:北京医科大学、中国协和医科人学联合出版社,1995.
[6] 丁钢强,郑军献,魏克民等.三叶青提取物对肝癌细胞HepG2及啄代大鼠肝细胞的体外毒作厢研究[J].浙江预防医学.2005.17
[7] 李瑛琦,陆文超,于治国.三叶青的化学成分研究[J].中草药.2003.34(11):982—983.
[8] Kobuchi H,Roy S,Sen CK,et a1.Quercetin inhibits inducible ICAM一1 expression in human endoth,tial cells through the JNK pathway[J]+Am Physiol,1999,227(3 Pt 1):CA03一C~111+f [9] Lee LT,Huang YT。Hwarlg JJ。et a1.Bha:ka,te of the epid,~'l'rlla]growthfactor receptor tyrosine kinase activity by quercetin and luteoin leads to growth inhibilion arid atx}pt.osis of pancreatic tumor cells【J].Antiean—eel"Res,2002,22(3):1615—1627.
[10] Jakubowicz—Gil J,Rzymowska J.Paduch R.et a1.The efect ofquercctin oa thc cxpression of heat shock pretems and apoptosis induction in monkey kidney cell line GMKI[J].Folra Histochem Cytobial,2002,40(2):137—138.
[11] RUS,aX)M,Palumbo R,Tedeseo I,et a1.Quereetin and anti— CD95 (Fas/Apo1)enhance apoptosis in HPB—ALL cell line[J].FEBS Le~tt,1999,462(3):322—328.
[12] Yokoo T,Kitmnura M.Unexpected protection of glomemlar mesangial cells from oxidant—triggered apoptosis by bioflavonoid quercetin[J] Am J Physiol,1997,273(2 n 2): o6一F212.
[13] lshikawa Y,Kitrnnura M.Anti—apoptotic efect of quemetin:interven—tion in the JNK and ERK—mediated apototic pathways[J].KidneyInt,2000,58(3):1078—1087.
[l4]田志刚.肿瘤生物治疗的一些热点问题[J].国外医学肿瘤学分册.1997.24(3):129.